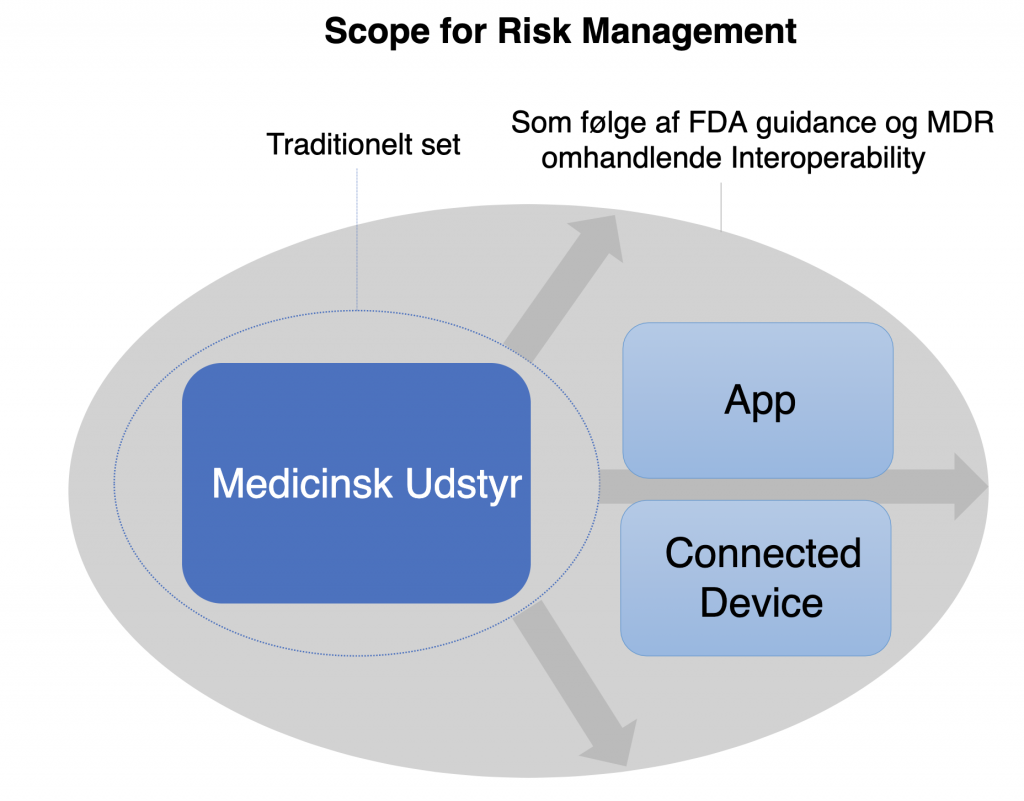
Vi har på få år bevæget os ind i en verden, hvor devices af alle slags er forbundne til apps, smartphones og andre apparater via bluetooth, NFC eller wifi. Det er typisk med til at gøre hverdagen nemmere og kommunikationen mere effektiv, men når høreapparatet, injektionspennen, pacemakeren eller noget så basalt som blodtryksmåleren kan videreformidle data, indgår det pågældende apparat pludselig i en konkret, medicinsk diagnosticering – og det stiller helt nye og meget strammere krav til sikkerheden og datahåndteringen end tidligere.
Udviklere og producenter af medicinsk udstyr er ansvarlige for at sikre, at udstyret er sikkert og effektivt ift. dets tilsigtede brug. Derfor er det altafgørende for producenter af stort set alle former for medico- og biotech-udstyr med medicinsk formål at tænke denne form for ‘interoperability’ ind i designfasen og risk management-processen fra start.
“I dag forventer de fleste, at apparater kan udveksle information, men det gør producenternes verden meget sværere, for nu skal man som producent også tage højde for, hvordan de forbundne devices anvender data. Hvis man fx fremstiller en blodtryksmåler, der sender data til en app, forventer myndighederne, at man kan redegøre for cybersecurity og risikoscenarier hos modtageren af dataene – fx en smartphone. Og det er et voldsomt skridt, hvor mange producenter meget hurtigt kommer uden for deres comfort zone og kan få brug for hjælp til evaluering af løsninger og formulering af robuste rationaler”, forklarer Peter Astrup, Senior Project Manager i Andreasen & Elmgaard A/S.
Tænk interoperability ind fra start
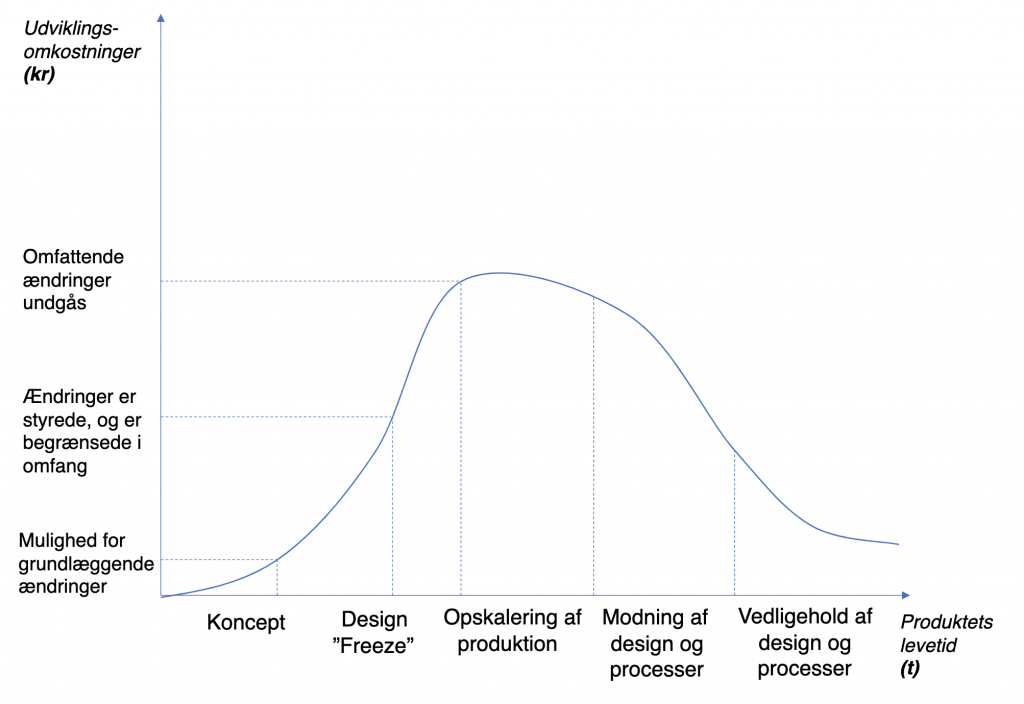
Andreasen & Elmgaard A/S er en rådgivende ingeniør- og konsulentvirksomhed, der har specialiseret sig i at hjælpe producenter i medico- og biotech-industrien med at overholde de stadig strammere krav til produkter, og her anbefaler man at sørge for at tænke interoperability ind fra starten af, så man undgår fordyrende tilbageløb i processen. Og da reglerne strammes på EU-niveau pr. 26. maj 2021, er det nu, der skal handles, råder Peter Astrup:
“Hvis man ikke er opmærksom på, hvor stor impact interoperability kan have, risikerer man at stå med forskellige problemstillinger. Hvis man fx vælger at ignorere interoperability i risikoanalysen, så vil myndigheden sige stop – og så skal man i værste fald lave sit produkt fundamentalt om, eller som minimum foretage en række fordyrende tests. Det kan fx være, at man skal implementere kryptering af data i sin software, og er man ikke en softwarebaseret virksomhed, kan det være en tung opgave at løfte. Det er ganske enkelt nemmere, billigere og mindre risikofyldt at tage interoperability seriøst fra starten af – fra den tidlige designfase og overførslen til produktionen, og i hele sin risk management”, siger Peter Astrup.
Udnyt konsulenternes erfaring
Andreasen & Elmgaard A/S rådgiver alle typer virksomheder på området, for selv store, velrenommerede virksomheder kan stå i en situation, hvor man ikke internt har erfaringen eller kompetencerne med de nye processer.
“Vi rådgiver projektledere, risiko managere og andre interessenter, så de kan træffe beslutninger på et mere robust grundlag. Det er ofte en fordel, at vi kommer udefra, for vi ser tingene på en anden måde og kan tillade os at stille de dumme spørgsmål. Vi har prøvet processen i mange sammenhænge og i mange discipliner, og vi kan bl.a. hjælpe med evaluering af den produkttekniske dokumentation, inden man skal inspiceres af FDA, Lægemiddelstyrelsen eller notified body, så man ved, at alt er i orden og at man er forberedt til at forklare sine beslutninger og rationaler. Og har man allerede observationer, der kan medføre designændringer efter inspektionen, kan vi også sørge for at facilitere processen for evaluering og udbedring af de observationer eller påbud, man har fået”, siger Peter Astrup.
Hvis du vil vide mere om Andreasen & Elmgaard A/S, kan du klikke ind på www.aoge.dk eller kontakte virksomheden direkte – for som deres motto lyder: “Det koster ikke noget at spørge”.
Andreasen & Elmgaard A/S er en rådgivende ingeniør- og konsulentvirksomhed, der har specialiseret sig i at hjælpe producenter i pharma-, medico- og biotech-industrien med rådgivning indenfor bl.a. Risk Management and Development Planning, Design Review, Design Verification, Design Validation, Design Transfer, Product Maintenance, UDI (Unique Device Identifier) samt fortolkning og implementering af relevante ISO-standarder, EU’s Medical Device Regulation og FDA’s regulativ om Design Controls.
Læs mere på www.aoge.dk

